別紙3
安全対策等業務(安全対策等拠出金)
(1) 趣旨
![]() 独立行政法人医薬品医療機器総合機構(以下「機構」という。)が実施する医薬品等の有効性及び安全性の向上に関する業務(安全対策等業務)に必要な費用に充てるため、医薬品等製造業者等(各年4月1日において薬事法(昭和35年法律第145号)第12条第1項又は第22条第1項の規定による医薬品若しくは医療用具の製造業の許可又は輸入販売業の許可を受けている者)が毎年度安全対策等拠出金(以下「拠出金」という。)を納付する。
独立行政法人医薬品医療機器総合機構(以下「機構」という。)が実施する医薬品等の有効性及び安全性の向上に関する業務(安全対策等業務)に必要な費用に充てるため、医薬品等製造業者等(各年4月1日において薬事法(昭和35年法律第145号)第12条第1項又は第22条第1項の規定による医薬品若しくは医療用具の製造業の許可又は輸入販売業の許可を受けている者)が毎年度安全対策等拠出金(以下「拠出金」という。)を納付する。
![]() 安全対策等業務とは、医薬品等の副作用等による健康被害の発生を防止するために必要な措置を講じることであり、市場に製品を供給する企業と国民の安全を確保する責務を負う国とがそれぞれの役割を果たすために実施しているところであるが、企業単独では実施困難な調査業務等を拠出金により機構が行うものである。
安全対策等業務とは、医薬品等の副作用等による健康被害の発生を防止するために必要な措置を講じることであり、市場に製品を供給する企業と国民の安全を確保する責務を負う国とがそれぞれの役割を果たすために実施しているところであるが、企業単独では実施困難な調査業務等を拠出金により機構が行うものである。
(2) 根拠法律
独立行政法人医薬品医療機器総合機構法(以下「法」という。)
(3) 実施主体
機構
(4) 主な業務
![]() 拠点病院ネットワーク事業(特定患者群の副作用情報の収集)
拠点病院ネットワーク事業(特定患者群の副作用情報の収集)
![]() 集積された副作用等情報を活用した疫学等科学的な解析
集積された副作用等情報を活用した疫学等科学的な解析
![]() 新たな副作用の検出技術(データマイニング手法)の導入
新たな副作用の検出技術(データマイニング手法)の導入
![]() ITを利用した情報提供
ITを利用した情報提供
![]() 医薬品等の基準案作成業務
医薬品等の基準案作成業務
(5) 財源
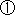 安全対策等業務に要する費用のうち、調査業務、消費者・医療関係者情報提供業務の一部及び基準案作成業務等に係る費用は、医薬品等製造業者等からの拠出金による(法第22条第1項及び第2項)。
安全対策等業務に要する費用のうち、調査業務、消費者・医療関係者情報提供業務の一部及び基準案作成業務等に係る費用は、医薬品等製造業者等からの拠出金による(法第22条第1項及び第2項)。
- ○ 拠出金額 = 算定基礎取引額 × 拠出金率
- ○ 算定基礎取引額 = 各品目の出荷数量 × 単価 × 傾斜係数
算定基礎取引額とは、医薬品又は医療用具をその副作用又は不具合の発生可能性に応じて区分し、各品目の出荷数量にその単価を乗じて得た額に、その区分ごとの一定の係数(傾斜係数)を乗じて得た額をいう。<傾斜係数> 品目ごとの副作用又は不具合のリスクを勘案し、補正するもの
- 医薬品
- 区分1 医療用医薬品(新薬) 2.0
- 区分2 医療用医薬品(注射剤等) 1.0
- 区分3 医療用医薬品(その他) 0.6
- 区分4 一般用医薬品 0.1
- 医療器具
- 区分A クラスⅢ・Ⅳ 1.9
- 区分B クラスⅡ 0.7
- 区分C クラスⅠ 0.1
- 医薬品
- ○ 拠出金率:現行0.11/1000(平成16年4月1日認可)
拠出金率は機構が定めることとされており、これを定め又はこれを変更しようとするときは、厚生労働大臣の認可を必要とする(法第22条第3項及び第4項)。 - ○ 拠出金率は、機構の中期目標期間(5カ年間)中の拠出金関係総事業費の支出見込額をもとに算定している。なお、今期5カ年の総事業費は、約47億円を見込んでおり、医薬品等製造業者等から各年度約9.3億円の拠出金の納付を予定している。
 国は、機構が行う安全対策等業務に要する費用のうち、医薬品副作用等報告受理収集業務、消費者・医療関係者情報提供業務の一部及び医薬品等医療安全情報業務に係る費用を運営費交付金として負担する。なお、平成16年度は、約2.9億円である。。
国は、機構が行う安全対策等業務に要する費用のうち、医薬品副作用等報告受理収集業務、消費者・医療関係者情報提供業務の一部及び医薬品等医療安全情報業務に係る費用を運営費交付金として負担する。なお、平成16年度は、約2.9億円である。。
(6) 拠出金の納付
 納付義務者:医薬品等製造業者等(法第22条第1項)
納付義務者:医薬品等製造業者等(法第22条第1項) 納付時期等
納付時期等
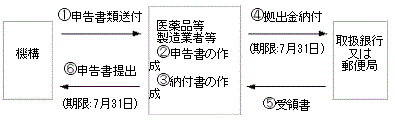
- ○ 申告及び納付期限:各年度7月31日までに拠出金を申告書に添えて納付しなければならない(独立行政法人医薬品医療機器総合機構法施行令(平成16年政令第83号。以下「施行令」という。)第24条において準用する同令第18条第1項)。
- ○ 医薬品等製造業者等が納付期限までに申告書を提出しないとき又は申告書の記載に誤りがあるときは、機構は拠出金の額を決定し、これを医薬品等製造業者等に通知する。この通知を受けた医薬品等製造業者等は、機構が決定した拠出金の全額又は不足額をその通知を受けた日から15日以内に機構に納付しなければならない(施行令第24条において準用する同令第18条第3項及び第4項)。
 申告・納付の手順
申告・納付の手順