別紙1
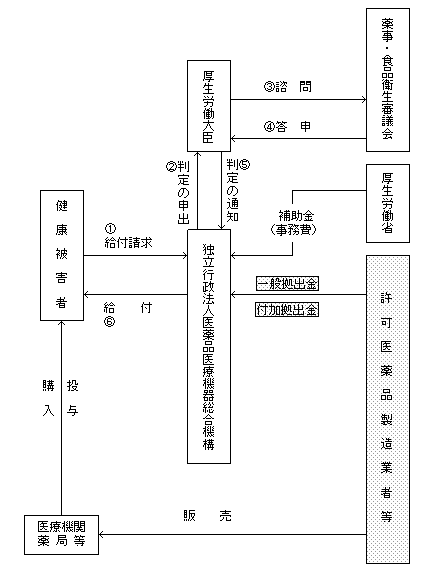
医薬品副作用被害救済制度(副作用拠出金)
(1) 趣旨
医薬品において、「有効性」と「副作用」とは不可分の関係にあることを踏まえ、医薬品の使用に伴い生じる副作用被害について、民事責任とは切り離し、医薬品の製造業者等の社会的責任に基づく共同事業として、迅速かつ簡便な救済給付を行うものである。許可医薬品製造業者等(各年4月1日において薬事法(昭和35年法律第145号)第12条第1項又は第22条第1項の規定による許可医薬品の製造業の許可又は輸入販売業の許可を受けている者(独立行政法人医薬品医療機器総合機構法(平成14年法律第192号)第4条第5項各号に掲げる医薬品のみを製造し、又は輸入している者を除く。))からの副作用拠出金(以下「拠出金」という。)により今後発生するかもしれない副作用被害の救済給付を行っていくという一種の保険システムである。
(2) 根拠法律
独立行政法人医薬品医療機器総合機構法(以下「法」という。)
(3) 経緯
サリドマイド、スモンといった医薬品の副作用による重大な健康被害の発生を教訓として、昭和54年10月に医薬品副作用被害救済基金(現在の独立行政法人医薬品医療機器総合機構(以下「機構」という。))を設立し、機構の行う業務として、昭和55年5月1日以降に使用された医薬品の副作用による健康被害に対する救済を実施。
(4) 実施主体
機構
(5) 救済給付の対象
医薬品が昭和55年5月1日以降に適正な目的で適正に使用されたにもかかわらず発生した副作用被害を対象とする。
 民事責任の追及が困難であることが前提
民事責任の追及が困難であることが前提
医薬品の製造業者、販売業者等、損害賠償の責任を有する者の存在が明らかな場合は、対象外(法第16条第2項第2号)。 「適正」に使用されたことが前提
「適正」に使用されたことが前提
本来の使用目的とは異なる「不適正目的」や使用上の注意事項に反する「不適正使用」の場合は、対象外(法第4条第6項)。 「副作用」に着目
「副作用」に着目
医薬品の薬理作用によって生じる有害反応である「副作用」が対象であり、医薬品に細菌やウイルス等が混入したことによる「感染」や異物による汚染は対象外(法第4条第6項)。 「重い」副作用が対象
「重い」副作用が対象
副作用の中でも「入院相当の治療が必要な被害」、「1・2級程度の障害」、「死亡」の場合を対象としており、軽微な副作用は対象外(独立行政法人医薬品医療機器総合機構法施行令(平成16年政令第83号。以下「施行令」という。)第3条及び第6条並びに法第16条第1項第4号及び第5号)。 「受忍」が適当でない副作用が対象
「受忍」が適当でない副作用が対象
「重い」副作用があっても使用が必要な抗がん剤等の医薬品(除外医薬品)による副作用、救命のためやむを得ず通常の使用量を超えて医薬品を使用したことによる副作用など、本来の治療のために受忍することが適当と考えられる副作用は対象外(法第4条第5項及び独立行政法人医薬品医療機器総合機構法施行規則(平成16年厚生労働省令第51号)第3条)。
(注) 「除外医薬品」としては、抗がん剤、免疫抑制剤等が指定されている。
(6) 救済給付の種類
入院相当の治療に要する医療費(医療保険の自己負担分の補てん)及び医療手当、障害が残っている場合の障害年金及び障害児養育年金、死亡した場合の遺族年金、遺族一時金及び葬祭料の7種類(法第16条第1項)。
(7) 財源
 給付に要する費用は、許可医薬品製造業者等からの拠出金による。
給付に要する費用は、許可医薬品製造業者等からの拠出金による。
拠出金には一般拠出金と付加拠出金がある。一般拠出金はすべての許可医薬品製造業者等が納付することとなるが、付加拠出金は被害の原因となった許可医薬品製造業者等が一般拠出金に付加して納付することとされており、各拠出金の算定方法は次のとおりである。- ○一般拠出金:医薬品の出荷額の一定割合(現行0.3/1000)を納付(法第19条第1項及び第2項)
- ・ 拠出金額 = 算定基礎取引額 × 拠出金率
- ・ 算定基礎取引額 = 各品目の出荷数量 × 単価 × 傾斜係数
算定基礎取引額とは、医薬品をその被害可能性に応じて区分し、各品目の出荷数量にその単価を乗じて得た額に、その区分ごとの一定の係数(傾斜係数)を乗じて得た額をいう。<傾斜係数> 品目ごとの副作用リスクを勘案し、補正するもの
- 区分1 医療用医薬品(新薬) 2.0
- 区分2 医療用医薬品(注射剤等) 1.0
- 区分3 医療用医薬品(その他) 0.6
- 区分4 一般用医薬品 0.1
- ・ 拠出金率:現行0.3/1000(平成16年4月1日認可)
拠出金率は、2/1000を超えない範囲で機構が定めることとされており、これを定め又はこれを変更しようとするときは、厚生労働大臣の認可を必要とする(法第19条第3項、第4項及び第6項)。 - ・ 拠出金率は、副作用救済給付に要する費用の予想額及び副作用救済給付業務に係る予定運用収入の額等に照らし、将来にわたって機構の副作用救済給付業務に係る財政の均衡を保つことができるよう算定している。
- ○付加拠出金:前年度に支給決定された救済給付の原因となった許可医薬品製造業者等が当該医薬品に係る給付現価の1/4を納付(法第19条第7項。前年度出荷額の1/100を上限とする。)
- ○一般拠出金:医薬品の出荷額の一定割合(現行0.3/1000)を納付(法第19条第1項及び第2項)
 国は、事務費の1/2を補助。
国は、事務費の1/2を補助。
(8) 拠出金の納付
 納付義務者:許可医薬品製造業者等(法第19条第1項)
納付義務者:許可医薬品製造業者等(法第19条第1項) 納付時期等
納付時期等
- ○ 申告及び納付期限:各年度7月31日までに拠出金を申告書に添えて納付しなければならない(施行令第18条第1項)。
- ○ 許可医薬品製造業者等が納付期限までに申告書を提出しないとき又は申告書の記載に誤りがあるときは、機構は拠出金の額を決定し、これを許可医薬品製造業者等に通知する。この通知を受けた許可医薬品製造業者等は、機構が決定した拠出金の全額又は不足額をその通知を受けた日から15日以内に機構に納付しなければならない(施行令第18条第3項及び第4項)。
 申告・納付の手順
申告・納付の手順

(参考図)
医薬品副作用被害救済制度の仕組み